전기이중층(inner and outer helmholtz layer)과 확산층
전극이 용액에 담기면, 전극과 용액 사이에서 +와 -가 서로 대전되는 현상이 일어난다. 그리고 이때 전극과 용액 사이에 확산층이 존재한다.

구조는 하단과 같으며, 크게 전기이중층과 확산층으로 나뉜다. 전기이중층은 전극 표면과 일정한 거리를 두며 모인 이온들이 있는 층인 '외부 헬름홀츠 평면(OHP : outer helmholtz layer)'와 전극표면에 모인 이온들이 있는 층인 '내부 헬름홀츠 평면(IHP : inner helmholtz layer)'로 나뉜다. 이 두 개의 평면을 합친 것을 '전기이중층'이라고 표현한다.
이를 넘어서면 이온들이 이동하는 '확산층'이라고 부르며, 확산층쪽으로 갈수록 이온의 농도는 낮아진다. *모이는 이온들이 적으니까

그리고 이 상태에서 전기화학 3전극 시스템을 이용해 전압을 가한다.
3전극은 작업전극, 상대전극, 기준전극으로 나뉜다. 기준전극을 기준으로 전압을 가하면 작업전극과 상대전극에 전위차이가 생기며 전류가 흐를 것이다.
이때 전극이 용액 안에 들어있는 상태에서 전기이중층과 확산층이 형성이 되고, 전압을 가하면 전류가 흐르며 전극 표면에 전하가 충전된다. 이를 'Double layer capacitance'라고 한다. 또한, 전하가 충전되는 동안 흐르는 전류가 '비패러데이 전류'라고 한다. 마치 커패시터와 유사하다.
전하가 충전될 만큼 되고 나면, 전극으로 전하 이동이 시작된다. 이때 흐르는 전류는 '패러데이 전류'라고 한다. 그리고 '패러데이 전류'가 흐를 때 생기는 저항이 'Charge transfer resistance(=Rct)'다.
Rct는 계면 사이의 저항인 셈이다. 그리고 이는 임피던스까지 이어지는 내용이다.
임피던스는 EIS (Electrochemical Impedance Spectroscopy, 전기화학 임피던스 분광법)로 측정이 가능하다. 이전에도 몇 번 포스팅한 적이 있는 내용이다.
EIS (Electrochemical Impedance Spectroscopy, 전기화학 임피던스 분광법), EIS 그래프 해석, 저항과 리액턴스
'EIS (Electrochemical Impedance Spectroscopy, 전기화학 임피던스 분광법)'이란? - 교류 전압(AC)을 인가해 나오는 저항을 알 수 있는 방법이다. *저항의 정도 - 시료에 주파수로 교류 전압을 인가하면(Sine wave)
washere.tistory.com
임피던스 해석법. 임피던스 실수부와 허수부의 의미는? EIS 해석법 nyquist plot
임피던스(impedance)는 이전에 설명했던 바와 같이 교류 전압을 인가했을 때 나오는 저항을 측정한다. EIS (Electrochemical Impedance Spectroscopy, 전기화학 임피던스 분광법), EIS 그래프 해석, 저항과 리액턴
washere.tistory.com
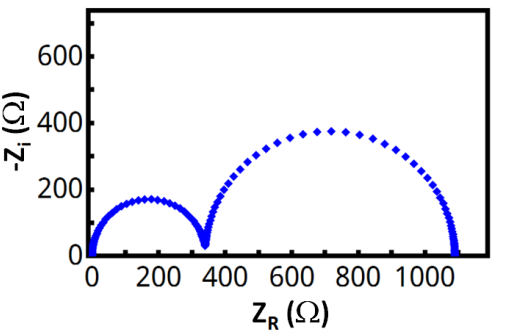
요약하자면, 임피던스는 교류전압에 대한 저항이다. 교류전압을 가하면 우리가 흔히 생각하는 저항과 리액턴스가 존재한다. 흔히 생각하는 전기저항이 X축인 실수부가 되고, 리액턴스는 Y축인 허수부가 된다. 그러면 Nyquist plot이라는 걸 얻을 수 있으며, 하단과 같은 그래프이다.
이때 X축에서 처음 찍히는 점이 Rs. 즉, solvent에 대한 저항으로 전해질 자체가 가지고 있는 저항값이라고 할 수 있다. 또한, 반원이 크게 두 개가 그려져 있는데 하단은 두 개의 회로가 결합된 경우고, 하나는 반원이 한 개다.
이때 반원의 지름을 통해 계면사이의 저항인 Rct를 파악할 수가 있다. 각 계산법은 이미지 참고

다음은 CV(cyclic voltammetry) 그래프이다. CV 역시 이전에 포스팅을 몇 개 했으니 간략하게 살펴보겠다.
Cyclic voltammetry(CV) principle - 순환 전압전류법 원리
앞서 전기변색 파트에서 종종 등장했던 'Cyclic voltammetry(CV) - 순환 전압전류법' 원리에 대해 좀 더 자세히 살펴보고자 한다. 'Cyclic voltammetry(CV) - 순환 전압전류법'은 전기화학에서 기초적이자 중요
washere.tistory.com
Cyclic voltammetry(CV) - 순환 전압전류법 원리 (2)
기존 Cyclic voltammetry(CV) - 순환 전압전류법에 대해 약간의 내용을 추가하고자 포스팅을 하나 더 하기로 했다. - CV의 원리 첫 번째 포스팅은 아래 링크 참조(추가로 같이 보면 좋은 글은 아래 링크
washere.tistory.com
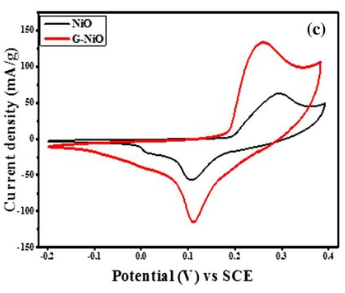
CV는 전압을 가하면서 산화환원 반응을 본다. 아래 그래프를 보면, 대략 0.25V쯤에 반응이 일어난다. 그렇다고 여기서 반응이 일어났다는 건 아니고, 반응이 정점을 찍은 곳이다. redox 전위라고 할 수 있다.
그래프를 확대해서 보면 0.1~0.2V 사이에 반응이 일어나기 시작하는데, 거기가 redox가 일어나는 시작점이다. 그렇게 반응이 시작되다가 대략 0.25V쯤에서 반응이 제일 활발하게 보이는 것이다.
앞서 전기이중층을 설명할 때, 전하 충전이 끝나고 전극으로 전하가 이동할 때, 패러데이 전류가 생기고 이에 따른 저항도 생긴다고 했다.
즉, 산화환원(redox)이 일어날 때, 전자와 이온이 계면을 넘어 이동하니까[(de)intercalation] 패러데이 전류가 흐른다. 이 때문에 y축이 크게 움직이는 것이다.
'과학과 공학 이야기 > 전기변색과 배터리' 카테고리의 다른 글
| LSV 테스트란? 선형주사전위법(Linear Sweep Voltammetry, LSV)이란? (4) | 2023.07.07 |
|---|---|
| 3전극 시스템 사용하는 이유 *2전극 시스템과 3전극 시스템 차이 (0) | 2023.03.06 |
| XPS 원리와 분석 방법, X-ray Photoelectron Spectroscopy 원리 (12) | 2022.12.05 |
| CA(Chronoamperometry)란 무엇일까? Chronoamperometry 원리 (0) | 2022.09.04 |
| UV/VIS/NIR Spectrophotometer 자외선/가시선 분광광도계란? (0) | 2022.04.08 |




댓글