2차 전지의 원리(=배터리의 원리는?)
· 1차 전지는 '건전지'와 같다. 방전만 되고 충전은 안된다. 2차 전지는 충전이 가능한 전지다. 요즘 쓰이는 배터리라고 생각하면 된다. 산화와 환원 반응을 이용해 방충전을 하는 데, 앞서 말했듯 2차 전지와 전기변색의 메커니즘은 유사하다.
· 산화는 전자를 잃는 것(방출), 환원은 전자를 얻는 것을 말하며, 리튬이 가볍고 에너지 밀도가 높아 대부분 전지의 양극재로서 사용 중이다.
· 전지의 구조는 양극, 음극, 전해질과 분리막으로 이루어져 있는데, 2차 전지에서 방전할 때에는 음극에 있는 전자가 양극으로 이동을 한다. 즉, 양극은 전자를 얻으니 환원이 일어나고, 음극은 전자를 잃으니 산화 반응이 일어난다.
2차 전지 방전 시
양극(Positive electorde)은 물질이 환원되는 쪽(Cathode)
음극(Negative electrod)은 물질이 산화되는 쪽을 말한다.(Anode)
· 반대로 충전시에는 양극에 있는 전자가 음극으로 이동을 하니까, 양극은 전자를 잃는 산화, 음극은 전자를 얻는 환원 반응이 일어난다.
2차 전지 충전 시
양극(Positive electorde)은 물질이 산화되는 쪽(Anode)
음극(Negative electrod)은 물질이 환원되는 쪽을 말한다.(Cathode)
· 이렇게 충방전에 따라 양극과 음극에서 산화와 환원 반응이 일어난다. 참고로 전기화학에서는 양극, 음극은 사실 애들 헷갈리게 만드는 잘못된 표현이다.
· 환원이 일어나는 환원전극을 cathode라고 하며, anode는 산화가 일어나는 산화전극이라고 한다. 즉, 방전 시 양극재가 있는 곳에선 환원이 일어나니 환원전극이 되어 cathode가 되는 것이다.
반대로 2차 전지를 충전할 때는 양극재가 있는 곳에선 전자가 음극으로 빠져나가 산화가 일어나니 anode가 된다.이렇게 충방전에 따라 산화전극과 환원전극은 뒤바뀐다.
좀 더 원리를 간단히 요약하기 위해, 아래 사진을 참고해보자.

저기서 양극재나 음극재 원소 사이사이에 조그마한 정사각형 ■ 친구들이 전자와 리튬이온(+)이다. 리튬은 음극재에 흑연 사이에 껴있다가 방전시 리튬이온과 전자로 나뉘며 그 사이에서 빠져나온다.(디인터칼레이션)
이후 리튬 이온은 전해질과 분리막을 거쳐 양극재 사이로 끼어 들어간다.(인터칼레이션) 그리고 전자는 도선을 통해 이동한 뒤 양극재 사이로 끼어들어간다.
전자가 이동하니까 전류가 흐르게 된다. 충전시에는 반대 반응이 일어난다. 이게 2차 전지의 원리다. 즉, 리튬이온이 양극재와 음극재 사이를 산화환원 반응으로 인해 와리가리하면서 전자가 이동하게 되며 충방전이 일어나는 것!
2차 전지 Intercalation 원리. 흑연 대신 실리콘을 음극재로 쓰려는 이유
Intercaltion, Deintercalation 뜻과 원리 Intercaltion, Deintercalation principle ▲ Intercalation 인터칼레이션 : 층상구조가 있는 물질의 층간에 분자, 원자, 이온이 삽입되는 현상. 그냥 끼어들기라고 보면 된다.
washere.tistory.com
'Redox(산화, 환원 반응을 칭하는 말)'는 환원전위(전자를 받으려는 경향성)에 따라 상대적으로 이루어진다. 환원전위는 각 물질에 따라 값이 다르며, 물질 2개가 있을 시 상대적인 환원전위 값에 따라 어떤 놈이 산화, 환원될지가 결정된다.

예를 들어 구리판의 환원전위는 +0.34, 아연판은 -0.76 일 때 두 물질을 전해질을 두고 연결하면 아연의 환원력이 더 낮으므로 구리가 환원되고 아연은 산화된다.
아연판을 은(+0.8)으로 바꾸면 환원력은 구리가 더 낮으니까 은이 환원, 구리가 산화가 일어난다. 이런 전위차로 인해 전자가 도선을 흐르는 힘이 기전력(electromotive force)라고 한다. 전위차가 높을수록 동작전압이 높기 때문에 좋다.
> 2차 전지에서 보통 음극 활물질은 흑연(탄소)을 쓰고, 양극 활물질은 코발트 등을 사용한다. *현재 음극 활물질로서는 흑연 대신 실리콘을 이용하거나 혼합하는 방법, 그리고 양극 활물질에선 코발트의 희소성 때문에 의존율을 줄이고자 노력하고 있다.
아무튼 방전 시 환원전위에 의해 음극에서 리튬이 산화되면서 리튬이온이 되고 전해질과 분리막을 통해 양극으로 이동하고, 전자는 전위차로 인해 도선을 통해 양극으로 이동하며 전류가 발생한다. 그리고 양극에 도착한 전자를 리튬이온과 만나 환원돼 양극에 삽입된다.
양극재
· 리튬의 원소 상태는 반응이 불안정해서 리튬산화물을 사용한다. 리튬산화물이 양극재로 갔을 때 안정적이고 반응을 잘 일어나게 도와주는 물질을 '활물질'이라고 하며 보통 양극재는 레이어, 스피넬, 올리빈 구조의 화합물을 쓴다.


1. 레이어(층상구조)
· 보통은 리튬코발트산화물(LiCoO2)를 많이 쓴다. 하지만 4.2 V 이상에서 불안정해지기에 이론 용량을 다 쓰지도 못한다. 그리고 LiCoO2의 특징은 저온(T=400℃)에서 스피넬 구조를 형성하고 온도가 증가(T≥600℃)되면 층상구조로 상전이 한다.
· 게다가 온도가 높을수록 암염구조로 상전이 한다. 이 때문에 LiCoO2는 고온에서 불안정하고 산소 이온이 이탈해 전해질에서 반응하여 폭발 위험이 있는 것이다.
· 테슬라의 경우 리튬·니켈·코발트·알루미늄산화(LiNi0.8Co0.15Al0.05)리튬·니켈·코발트·알루미늄 산화(LiNi0.8 Co0.15 Al0.05)가 양극재인 리튬이온 배터리를 쓴다. 하지만 가격이 너무 비싸니, 중국 CATL과 손을 잡고 리튬인산철(LFP) 배터리 방식도 생산하고 있다. 이는 에너지 밀도가 낮지만, 큰 문제가 없다고 보고되고 있고, 그만큼 가격이 저렴해진다.
· LG화학과 삼성SDI는 리튬·니켈·코발트·망간(NCM)을 사용하고 있고, LG화학은 NCMA(니켈-코발트-망간-알루미늄)을 내년에 양산할 계획이라고 발표했다.
· 여기서 코발트는 양극재 소재로서 10~20%를 차지하는데, 반응성과 안정성이 높다는 장점이 있다. 다만, 코발트의 수급이 불안정하며 가격 또한 비싸다. 코발트 외 물질을 상용하긴 하나 충방전 중 상변이가 일어나 불안정성이 커 연구가 진행 중이다. 각 기업들은 코발트 함량을 조금씩 줄이고 있고, 코발트 제로를 목표로 연구가 이뤄지고 있다.
2. 스피넬
· 층층마다 이루어진 게 아니고, 금속산화물과 이온이 한 줄로 교대로 배열돼있다. 대표적으로 리튬 망간 산화물(LiMn2O4) 안정성과 리튬의 확산속도는 좋은데 용량이 떨어진다.
· 이는 가격이 저렴한 Mn의 사용으로 비용면에서 우수하지만, 고온에서 전이금속인 Mn이 전해질로 용출되어 급격한 용량 감소라는 수명 문제를 지니고 있어 상용화에 어려움이 있었다.
· 이 용출 현상을 야기하는 결정 구조 내의 Mn(III) 이온을 부분적으로 다른 전이금속으로 치환함으로써 수명 특성을 향상하면서 고출력 저비용 양극소재로써 새롭게 각광받고 있는데, 연구가 진전이 있는지는 잘 모르겠다.
3. 올리빈
· 철을 사용한 건데 철산화물과 다원자이온, 리튬이 구조로 돼 있다. 보통 리튬인산철(LiFelPO4)를 사용한다. 철이 널려서 좋긴 한데, 전기전도도와 확산속도가 너무 느려서 사용하기엔 무리가 있다.

· 표를 보면 구조와 화합물 전지용량(Specific capacity)이 있는데 이론용량, 괄호 안이 실제용량이다. 위에 설명한 것처럼 안정성으로 이론용량에 절반밖에 쓰지 못하거나, 상변이가 일어난다. 그 외 스피넬, 올리빈은 이론용량이 작거나 전압과 전기전도도가 낮다.
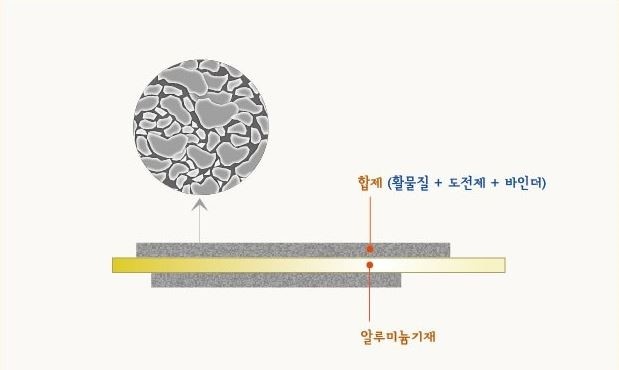
합제
· 양극을 좀 자세히 보면 양극의 틀을 잡아주는 얇은 알루미늄 기재에 활물질과 도전제, 바인더가 섞여있는데 이를 '합제'라고 부른다. 도전제는 전도성을 높이기 위함이고, 바인더는 활물질과 도전제가 잘 붙어있을 수 있는 접착을 돕는 역할이다.
음극재
· 음극은 안정적인 구조를 지닌 '흑연(Graphite / 탄소)'를 쓴다.
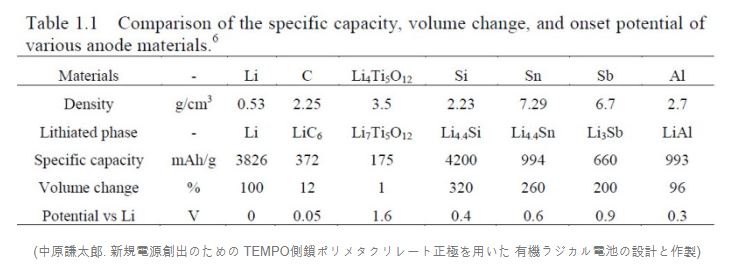
· 이유는 표와 같다. 배터리 음극재로 사용하기 위해선 경량화를 위해 재료의 밀도가 낮고 부피 변화가 적어야 하며, 에너지 밀도는 높은 것이 좋다. 그리고 양금과 음극의 전위차가 많이 나는 것은 고전압이 되는 것인데 이를 위해 음극에 전위는 낮은 게 좋다.
· 이러한 조건들을 만족시키고 심지어 구하기도 쉬운 것이 흑연이다. 초기엔 리튬을 썼다지만, 금속판에 불순물이 생겨 성능 저하가 됐고, 탄소 외 타이타늄산화물, 규소 등을 써봤지만 조건이 맞지 않았다고 한다.
· 하지만 작년에 테슬라가 실리콘 음극재를 특허를 냈듯이, 배터리의 용량이 점점 커지며 저장능력이 높은 실리콘 음극재가 주목을 받고 있다.
· 실리콘은 흑연보다 약 4배 이상 저장 능력이 높다. 다만, 실리콘 음극재를 사용하면 리튬이온의 20%가 화학반응으로 손실이 된다. 단점을 막고자 배터리 조립 전에 음극에 리튬을 미리 넣던지 등에 방법을 연구했지만, 리튬 분말에 가격과 화재 위험성으로 상용화하지 못했다.
· 테슬라는 리튬, 니켈, 구리 산화물을 사전 리튬화 재료로 사용하도록 하며 테스트를 진행했다고 하는데, 이와 같은 특허가 얼마 후 배터리 데이 때 공개가 될지가 주목되고 있다. (*결국 공개되지 않았다.)
분리막
· 전자가 전해질을 통해 이동한다면 전지가 제기능을 못한다. 게다가 양극과 음극이 만나면 아무것도 안 일어나고 위험하기만 하겠지. 아를 막아주고, 전해질과 반응하지 말아야 하며 산화, 환원 시 적절한 이온이 통과할 수 있도록 미세한 기공이 있어야 한다. 폴리에틸렌(PolyeEthylene), 폴리프로필렌(PolyProplylene)을 이용한 고분자막을 많이 쓴다.
전해질
· 이온과 이온의 수송을 책임진다. 전자는 도선을 통해 산화 환원된 이온은 전해질을 통해 이동하니까 말이다. 리튬이온이 변하지 않고 잘 이동해야 하니, 화학적 반응성은 낮고 이온 전도도는 높아야 한다.

전해질은 염과 용매, 첨가제로 구성되어 있는데, 각 역할은 아래와 같다.
염 : 리튬이온이 지나갈 수 있는 이동 통로 > 염은 리튬화합물로서 리튬6플루오린화인(LiPF6)나 리튬4플루오린붕소(LiBF4) / 음이온은 화학적 반응성이 적은 이온이 쓰인다.(플루오린이 대표적인 내화학성)
용매 : 염을 용해시키기 위해 사용되는 유기 액체 > 용매를 고체냐 액체냐에 따라 다른데, 고체로 쓴 걸 리튬 폴리머 배터리라고 한다. 액체는 EC(Ethylene Carbonate), DMC(Dimethyl Carbonate) DEC(Diethyl Carbonate) 등, 고체는 PAN(Polyacrylonitrile), PMMA(Poly Methyl Metharcylate) 등이 쓰인다.
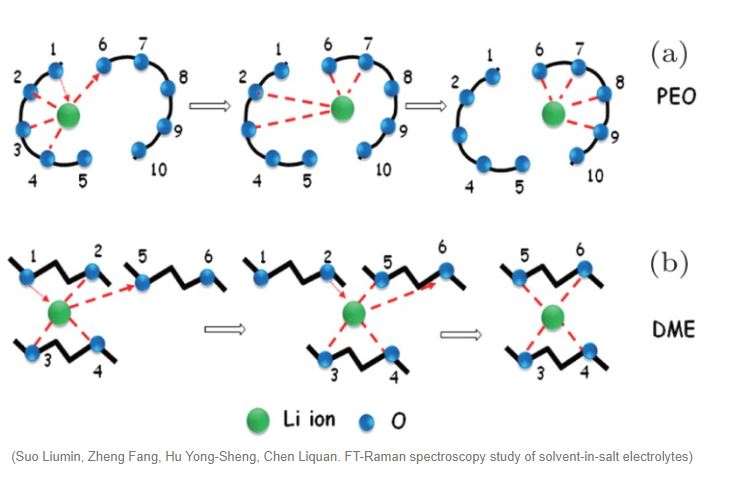
고체에서의 이온 이동은 위와 같이 일어나는데, 여기서 말하는 고체란 젤 형태를 말한다. 젤 형태의 고분자들의 전자친화도가 높은 분자들한테 리튬이온이 전기적 인력으로 달라붙고, 다시 인접한 고분자 반복 단위의 전자친화도가 높은 원자에 들러붙으면서 옮겨간다. 한마디로 액체에서 이온이 싹 다 이동했다면, 고체는 리튬이온만이 이동하는 개념인 셈이다.
첨가제
· 특정 목적을 위해 소량으로 첨가되는 물질 > 효율 수명 안정성 등을 높일 수 있다.
'과학과 공학 이야기 > 전기변색과 배터리' 카테고리의 다른 글
| 전기변색(Electrochromic) 세 번째와 분광광도계(spectrophotometer)의 원리 (0) | 2020.10.06 |
|---|---|
| 2차 전지 Intercalation 원리. 흑연 대신 실리콘을 음극재로 쓰려는 이유 (0) | 2020.09.22 |
| 전기변색(Electrochromic) 두 번째 (0) | 2020.09.11 |
| 전기변색(Electrochromic) 첫 번째와 PDLC (0) | 2020.09.10 |
| 전기 이중층 개념과 원리 (EDL : Electrical Double Layer) (0) | 2020.09.09 |




댓글