전기변색은 전극에 전지를 가해서 전위차를 일으키고, 이때 산화 환원 반응이 일어나면서 물질의 투과도 및 색이 변하는 것을 말한다.
무기물로는 산화텅스텐, 유기물로는 바이올로젠을 대표적으로 사용되고 있다. 이 두 물질은 모두 환원이 됐을 때 어두운 청색을 보임으로서 건물 및 자동차, 비행기 등에 유리에 많이 응용되고 있다.
전에 글을 게시했지만, 한번 더 정리하자면 삼산화텅스텐 내에는 W6가가 존재한다. 이때 전위차로 환원(전자를 받아줌)이 되면서 W6 >> W5가가 된다.
이때 전자의 intercalation(기존 물질에 끼어들음)으로서 물질을 구성하고 있는 틀인 격자가 불안정해진다.(그리스 신전처럼 큰 기둥들이 건축물을 지탱하고 있는데, 이 기둥 사이에 다른 물질들이 끼어들어가거나 들어가기 위해 쾅쾅된다면 기둥은 미시적으로라도 흔들릴 것이다)
이렇게 환원이 됨으로써 전자가 들어오고 그 사이에 낑겨들어가려고 하면서 격자는 불안정해지는데, 이 때문에 '포논(phonon)'이 발생한다. 포논은 '진동하는 에너지'이며, 전자와 포논이 결합한 것을 '폴라론(polaron)'이라고 한다. 극성은 띈 입자라고 보면 된다.
이 폴라론은 격자를 자유롭게 이동하면서 광흡수가 일어나고 이로 인해 투과율 감소와 동시에 착색이 일어나는 것이다.
산화텅스텐은 팔면체로서 edge, corner sharing으로 안정적인 구조를 띄고 있다.
이는 ReO₃ (empty pervoskite structure) 구조라고 말하기도 한다. 저 pervoskite 구조가 어떤 형태를 가지고 있는 것이고, 또 산화텅스텐은 어떤 구조 형태를 가졌기에 좋은 건지에 대해서 글을 작성해보려고 한다.
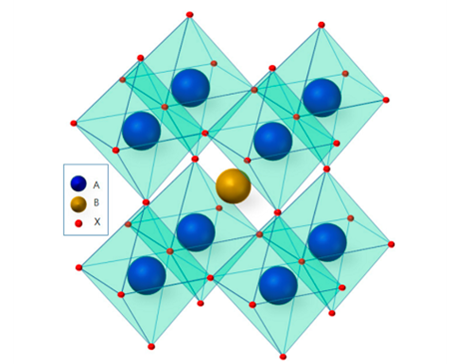
상단 이미지가 페로브스카이트 구조이며 특징은 아래와 같다.
ㆍABX3 : 크기가 다른 양이온과 음이온 비율 1:1:3
ㆍ전자와 정공의 수명과 확산 거리가 길다. = 엑시톤 결합 에너지 ↓
상이 안정적이고, 전자와 정공이 멀리 떨어져 있어서, 결합 에너지가 낮다. 전자와 정공이 재결합할 확률이 낮기 때문에 태양전지에서도 지속적으로 연구 중인 구조다.
재료공학에서는 원자가 어떤 배열을 하는지에 따라 아래와 같은 사진처럼 여러 모양으로 구분을 해놨다. 각 상마다 특징을 가지고 있고, 이에 따라 재료의 성질이 달라질 수 있다.
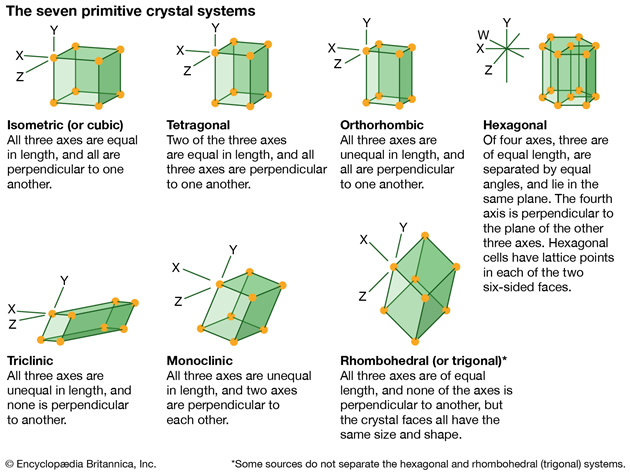
몇 가지만 살펴보자면, 가장 안정적인 상은 왼쪽 상단 첫 번째에 있는 'cubic(정방정계)'로서 딱 봐도 안정적인 정육면체이다.
두 번째 줄에서 가운데 'monoclinic(단사정계)'는 위에서 압력을 가해 살짝 휘어지고 찌그러진 직육면체 모양을 보인다. 보통 저런 단사정계는 대칭성이 떨어져서 음이온과 양이온이 대칭적으로 존재하지 않는다.
이 때문에 한쪽으로 음이온이나 양이온이 쏠려서 유전율을 보이는 경우가 많다. 대표적으로 BaTiO3, ZrO2 등이 있다. 그 외 'hexagonal(육방정계)', 'tetragonal(정방정계)' 역시 꽤나 안정적이라서 '준안전상'이라고 한다.
이처럼 배열에 따른 많은 구조를 가지고 있고, 삼산화텅스텐은 온도에 따라 상(phase)이 변하는 모습을 보여준다.
ㆍMonoclinic (ε-WO3, T < −43 °C) 단사정계
ㆍTriclinic (δ-WO3, −43 ~ 17 °C) 삼사정계
ㆍMonoclinic (γ-WO3, 17 ~ 330 °C) 단사정계
ㆍOrthorhombic (β-WO3, 330 ~ 740 °C) 사방정계
ㆍTetragonal (α-WO3, T > 740 °C) 정방정계
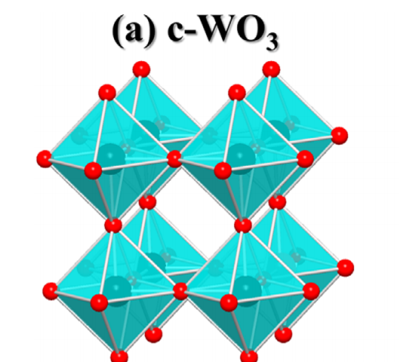
그리고 Li과 같은 불순물 원자가 있을 때는 안정적인 cubic phase 형성한다. 삼산화텅스텐은 실온에서는 단사정계 형태를 가지고 있어 꽤나 안정하면서도 반응이 잘 일어날 수 있고, 불순물 원자가 있을 때는 정방정계 형태로 안정적인 상을 취하니, 반응하기가 딱 좋아보인다. 게다가 변색은 어두운 청색, 그리고 적당한 밴드갭을 가졌으니 제어가 용이하기 때문이라고 생각한다.
그렇다면 왜 삼산화텅스텐만 사용하는 것일까? 이산화텅스텐은 사용할 수 없는 걸까 해서 찾아봤더니.
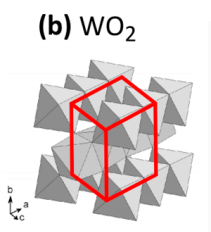
이산화텅스텐 역시 '단사정계' 모양을 가지고 있다. 그리고 색깔은 환원이 됐을 때 갈색으로 변하는데, 아무래도 일단 활용도가 청색에 비해 많이 떨어진다. 그리고 이산화텅스텐은 착색이 됐을 때 갈색으로 변색이 된다.
ㆍWO₂ : brown (monoclinic)
ㆍWO2.9 : bluish-violet
ㆍWO2.72 : redish-violet
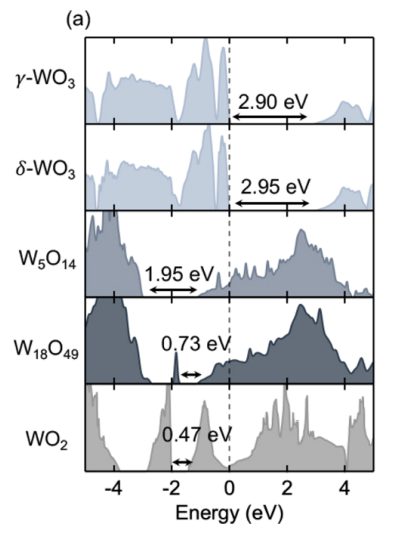
위 사진은 에너지 밴드갭(가전자대에 있는 전자가 전도대로 넘어가는 데 필요한 에너지)을 정리한 사진이다. 이산화텅스텐이 가장 밴드갭이 낮은 0.47 eV를 보여준다.(삼산화텅스텐은 2.9 ~ 2.95 eV)
WO2는 변색이 갈색으로 되어 대중적으로 사용되기엔 애매한 색상과 밴드갭이 너무 낮으면, 적은 전압으로도 전자가 넘어갈 수 있으니 제어가 어렵고, 반대로 고전압을 줬을 때는 전자가 과하고 빠르게 흘러 열이 발생하고 소자가 손상될 가능성이 있어 사용하지 않는 것 같다는 게 내 생각이다.
'과학과 공학 이야기 > 전기변색과 배터리' 카테고리의 다른 글
| 전기변색(Electrochromic) 7 번째 : 분광전기화학(Spectroelectrochemistry)과 전도성 고분자의 정의 (0) | 2021.04.12 |
|---|---|
| 전기변색(Electrochromic) 6 번째 : 효율을 나타내는 지표 (7) | 2021.04.11 |
| 전기변색 번외 : 서울대의 전기변색 기반에 디스플레이 소자 개발 (0) | 2020.10.11 |
| 전기변색(Electrochromic) 네 번째 : 전기증착, 스퍼터링, 진공증착 (4) | 2020.10.07 |
| 전기변색(Electrochromic) 세 번째와 분광광도계(spectrophotometer)의 원리 (0) | 2020.10.06 |




댓글